医耘沙龙丨肿瘤药物靶点LAG-3研究与投资机会探讨
2019年11月21日“医耘沙龙”第七期肿瘤药物靶点LAG-3投资研究主题深度沙龙如期举行,本次沙龙由华医资本旗下医耘资本、胡润百富、佰傲谷以及杭州银行联合筹备,邀请了医耘资本董事总经理程超博士介绍LAG-3的机制及临床情况,同时邀请了LAG-3 临床速度第一梯队的维立志博康小强博士做深入探讨;后续与会投资方与企业嘉宾展开了深入沟通,收获满满。
核心要点:
1、LAG-3靶点的机制并不完全明确,需紧跟科研前沿;
2、临床结果差异较大,需要关注被投企业的临床数据;
3、国内外的临床进展差异不大,临床阶段适应症不错,有望成为大药,效果值得期待。
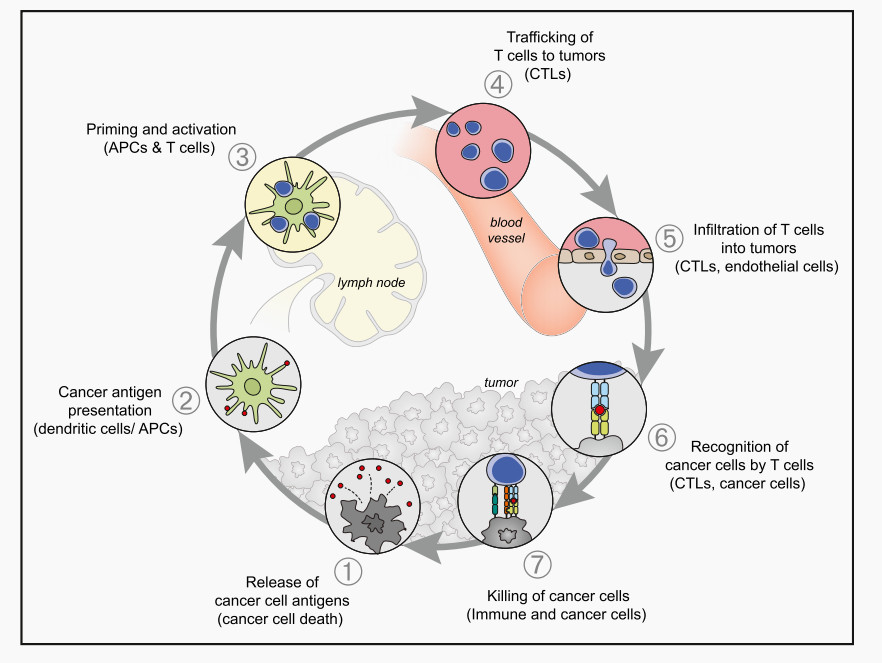
2013年,两位肿瘤免疫学专家Ira Mellman和Daniel S. Chen首次于《immunity》杂志上完整描述了整个肿瘤免疫循环过程,过程共分为七个步骤(图1):
图1:肿瘤免疫循环过程
图片来源:文献【1】
每个步骤都有相应的刺激(绿色)和抑制(红色)因素,来维持免疫系统的正常活化(图2)。其中不乏我们熟悉的免疫检查点如PD-1/PD-L1和CTLA-4,以及我们本篇研报的主角LAG-3。
图2:肿瘤免疫循环过程中的一些靶点
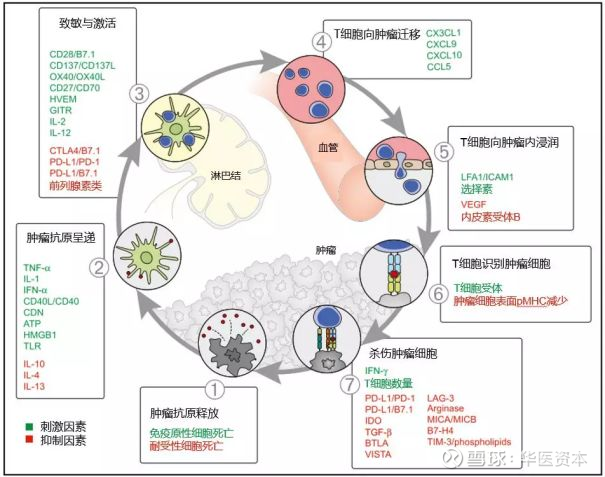
图片来源:文献【1】
在详细介绍LAG-3前,我们先要谈谈PD-1的现状。目前,以PD-1/PD-L1抑制剂为代表的免疫治疗药物进入快速增长期。据悉默沙东的K药在2018年销售收入71.17亿美元,并且百时美施贵宝的O药在2018年的销售收入达到了67.35亿美元。但是,对于大多数实体瘤患者来说,PD-1/PD-L1抑制剂只对20%-30%的患者有效。在这些应答的患者中,后续仍会有10%-15%的患者出现耐药。
因此,将PD-1 / PD-L1与其他药物联合使用,已成为提高肿瘤免疫疗法临床疗效的主要策略。由于LAG-3和PD-1在机制上具有互补性,LAG-3抑制剂变得备受关注。
LAG-3机制并不完全明确,需紧跟科研前沿
TRIEBEL等[2]于1990年首次从人源MB-F55IIIE5亚文库中分离出LAG-3特异性的cDNA克隆。随后LAG-3被发现主要表达在活化的T细胞、B细胞、NK细胞和树突细胞上。
正常情况下,LAG-3 和其配体介导负性信号,调节T细胞增殖和功能,维持机体T细胞的稳态。在肿瘤环境中,LAG-3和其配体介导的负性信号减弱CD4 + T和CD8 + T细胞增殖、分化,并促进Treg细胞的分化。
已有研究报道,LAG-3 在多种实体恶性肿瘤的TIL上高表达。
至今,已发现的LAG-3 配体共有5种:MHC-II,肝窦内皮细胞凝集素(liver sinusoidal endothelial celllectin,LSECtin)、半乳糖凝集素-3(galectin3)、α-突触核蛋白原纤维 (α- synucleinfibrils),以及陈列平团队在去年发布于Cell上的纤维蛋白样蛋白1(fibrinogen - like protein 1,FGL1)。
图3 : LAG-3受体
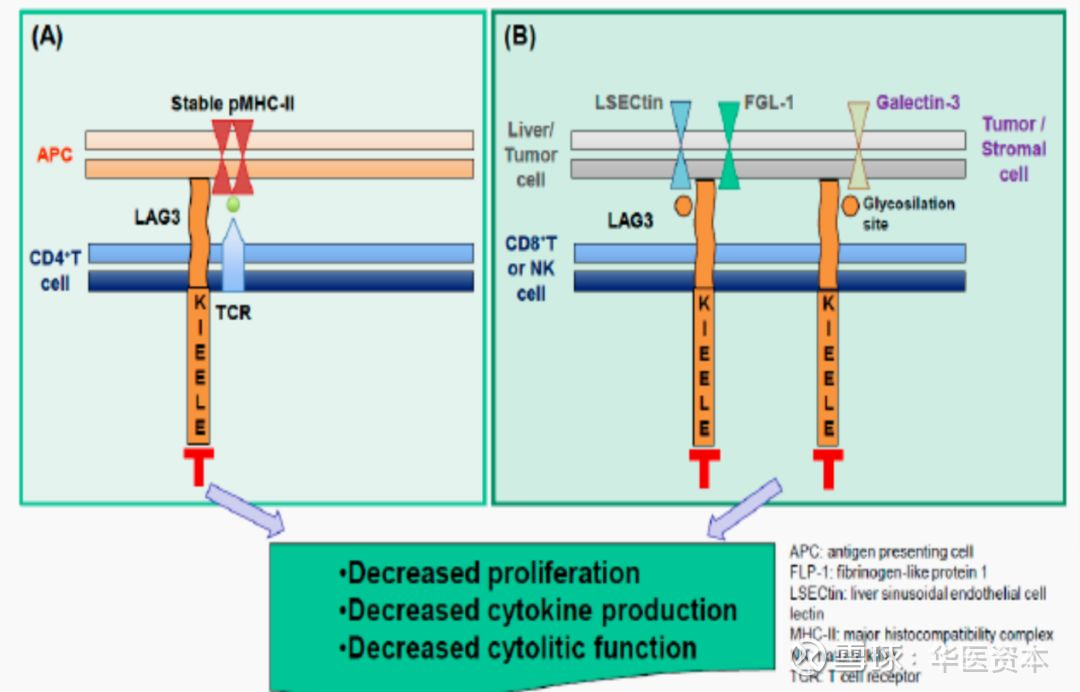
图片来源:文献【3】
关于LAG-3机制的文章已经很多,由于篇幅有限,本文不再赘述(详细的版本可通过华医资本公众号后台留言索取)。但是目前机制上还存在很多未知:
第一,LAG-3 是否还有其它潜在配体?LAG-3不仅表达在激活的CD4 + T细胞和CD8 + T细胞上,LAG-3也表达在NK细胞和B细胞上,但是这些细胞不和MHC II 结合,那么是否有其他配体。另外,LAG-3 是否可以通过调控 NK 细胞或 B 细胞来发挥抗肿瘤作用 ?这些都有待进一步研究;
第二,LAG-3 与配体结合后发挥的生物学功能仍不清楚,LAG3信号参与TCR信号的功能,但是如何介导并不清楚,其负向调控 T 细胞功能的具体机制有待于进一步研究 ;
第三,不同免疫检查点抑制剂发挥协同作用的分子机制尚不清楚,仍需寻找最优的免疫检查点组合,发挥联合用药的最大抗肿瘤效果和最小副作用;
因此,我们可以发现近几年发的文章都在努力解答这些问题,比如2018年陈列平团队【4】发现新配体FGL1,以及 Maruhashi, T., Okazaki, I., Sugiura 等【5】发现LAG-3不会直接干扰T细胞抗原受体与MHC II类之间的相互作用,而是通过其细胞内区域转导抑制信号,优先抑制对稳定的pMHCII反应的T细胞。
临床结果差异较大,需要关注被投企业的临床数据
虽然机制并无完全明确,但是LAG-3抑制剂的临床已经进行的如火如荼。2013年,全球仅有一项LAG-3靶点药物的临床试验。2017年,临床试验已开展至21项。到2019年初,临床试验数量已增加到47个。
目前公布数据的企业包括:BMS、默沙东、Immutep等。
其中分享的数据比较详细的是BMS,BMS根据患者的LAG-3表达量,对患者做了分群分析。
较早的数据来自于2017年,BMS在ESMO年会上公布的数据。在一项称为CA224-020的1 / 2a期临床试验中,relatlimab和Opdivo(由BMS开发的PD-1抑制剂)构成了针对实体瘤患者的联合疗法。这些患者包括对PD-1 / PD-L1免疫疗法无反应的黑色素瘤患者。结果显示,肿瘤周围免疫细胞中LAG-3表达量大于1%的患者的组合疗法的客观缓解率(objective response rate, ORR)是18%,而表达LAG-3小于1%的患者的ORR仅为5%。
随后BMS公司又在ASCO公布了启动全球范围的II/III期临床试验的小规模临床试验数据:
共有55位恶性黑色素瘤患者入组,其中近一半的患者都接受过3次及以上的治疗,包括PD-1抗体,并产生耐药。本临床试验的方案是:使用relatlimab 80mg 联合 PD-1抗体O药240mg,每两周一次静脉注射。
结果显示:对于LAG-3表达量大于1%的25位患者来说,ORR是20%;而对于LAG-3表达量小于1%的患者,ORR仅有7.1%。对于重度难治的患者来说,20%的ORR疗效实属不错了。
图4、relatlimab 联合PD-1 部分临床结果
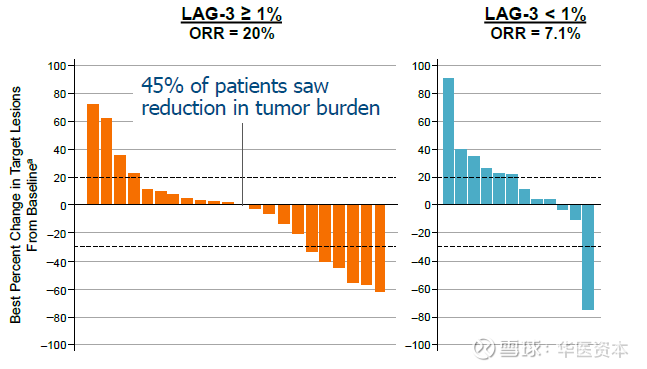
图片来源:BMS 2017 ASCO Presentation
另外一项可可溶性LAG-3融合蛋白的临床结果也值得期待。在一项名为TACTI-002的2期临床试验中,Eftilagimod alpha与PD-1抑制剂Keytruda(pembrolizumab)联用用于治疗头颈癌患者和不同类型的NSCLC患者。其中试验A部分队列1的患者是从未接受过Keytruda治疗的NSCLC患者,这里不考虑患者的PD-L1表达水平。试验结果表明,在这17位患者中,使用联合用药的疾病控制率达到76.5%,其中7位产生部分缓解(41.2%),另有6位患者疾病稳定。截止临床数据公布时,仍然有12名患者在继续接受治疗。但是需要注意的是,在这里并没有提到单独用LAG-3融合蛋白的临床效果,因此后续的临床效果还值得持续关注。
但是也有些临床试验的效果并未非常突出,由Immutep S.A.研发,目前由诺华公司与Prima BioMed联合研发的LAG-525,目前正在开展和spartalizumab (PD-1单抗)的临床试验。在2018年的ASCO上,一项是治疗恶性肿瘤的一二期临床(临床试验注册号NCT02460224)显示,在采用联合用药的121位患者中1位完全缓解和11位部分缓解。从整体来看,缓解率并不高,但是这里没有根据患者对适应症进行区分,希望未来还有更多的数据可以出来。
然而,这里也有一个问题值得关注,目前效果比较好的适应症是恶性黑色素瘤(在我国是小适应症),其他适应症的效果如何?
从下图我们看到在全球范围内各个适应症的临床正在积极展开,在未来几年数据应该会逐渐完善起来。
图5:全球临床试验
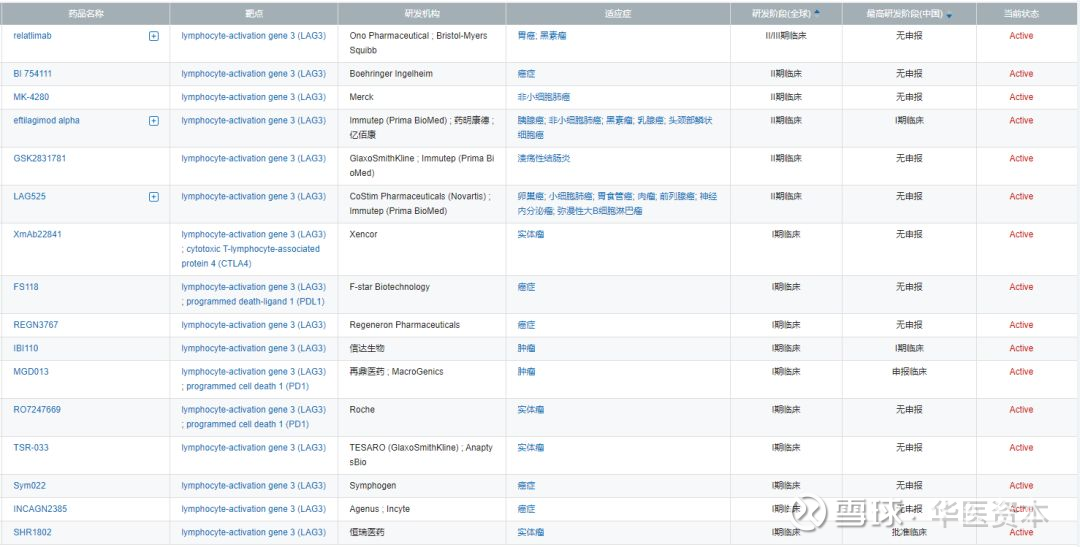
图片来源:医药魔方 NextPharma(R)全球新药数据库
国内外的临床进展差异不大,介于临床效果有所期待,建议关注处于临床I期的公司。
目前全球同靶点的药物尚未上市,研发进展最快的是BMS(百时美施贵宝)的Relatlimab,已经启动全球范围的II/III期临床试验。
国际:1款处于临床II/III期,另外有5款药物处于临床II期(见图5)。
国内:4款处于临床I期/刚批临床的药物,另外有6个药物处在临床前阶段。其中信达生物(IBI110)于2019年4月获批临床,维立志博生物(LBL-007)相关药物于5月获批临床,恒瑞医药SHR-1802的临床试验申请也11月获批临床,在临床速度上属于第一梯队有先发优势。
图6:我国LAG-3临床试验
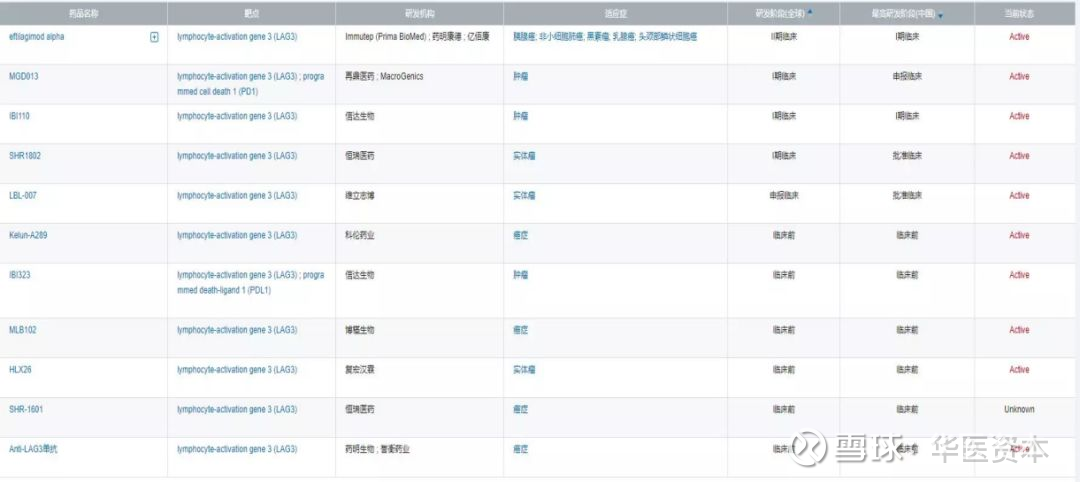
图片来源:医药魔方 NextPharma(R)全球新药数据库
由于信达生物和恒瑞医药均已上市,作为临床的资金也会更加雄厚。那么作为新型的创新药公司维立志博会如何保持自己的临床优势?我们也请教了维立志博的康博士。康博士说,在商业化策略的选择上,项目已经到了临床I期阶段,随后维立志博会寻求合作伙伴,共同完成II期、III期临床试验。
嘉宾分享
医耘资本董事总经理程超博士介绍了LAG-3的机制,临床情况及投资要点。

随后,维立志博创始人康小强博士对Lag-3做了深度分享,介绍了LAG-3和其它抑制性免疫检查点的区别,并详细介绍了维立志博的抗LAG-3抗体的临床前情况以及目前临床策略。

参考文献:
【1】Daniel S. Chen and Ira Mellman. OncologyMeetsImmunology:TheCancer-ImmunityCycle. Immunity. 2013 Jul 25;39(1)1-10
【2】HE Y, RIVARD C J, ROZEBOOM L, et al. Lymphocyte-activation gene-3, an important immune checkpoint in cancer[J]. Cancer Sci,2016,107(9):1193-1197. DOI:10.1111/cas.12986.
【3】Cancer 2019,11,1213
【4】Wang et al. Fibrinogen-like Protein 1 Is a Major Immune Inhibitory Ligand of LAG-3, Cell (2019), 网页链接
【5】Maruhashi, T., Okazaki, I., Sugiura, D. et al. LAG-3 inhibits the activation of CD4+ T cells that recognize stable pMHCII through its conformation-dependent recognition of pMHCII. Nat Immunol 19, 1415–1426 (2018) doi:10.1038/s41590-018-0217-9