精准医疗下肿瘤靶向药物投资研究体系
于2018年10月公布的《全球肿瘤免疫治疗发展趋势》中提到,全球有临床在研项目靶点417个。当靶向治疗成为趋势,抗肿瘤药物投资研究也应当更加“精准”,而不是仅仅以传统的肿瘤适应症分类方式研究。面对数量繁多的靶点使得,如何系统地去研究每个靶点的潜力、市场、竞争等投资要素成为难题。
我们认为通过药物靶点的作用机制分类,一个类别的靶点相互比较研究,由于同一类靶点(如受体类酪氨酸激酶、血管形成靶点)会有一定的共性,所以对同一类靶点相互比较能更清晰地了解其优势。然后将其中的新药再与临床一二线药物数据相比较,这才是符合当下的投资研究思路。
我们正在分靶点类型进行研究并且现阶段我们已经发现了一些具有成药性,极具潜力的靶点,欢迎各位补充和共同探讨。
肿瘤治疗靶向药物研究体系
癌症历年高发
癌症已经成为世界上发病率和致死率最高的疾病之一。
根据世界卫生组织统计2018年全世界癌症发病案例1800多万例和960万癌症死亡病例。传统癌症三大疗法,化疗、放疗和外科手术无法完全解决癌症的复发或已转移的肿瘤。免疫疗法,精准靶向治疗成为科研、投资的热门方向之一。
中国肿瘤靶向药现状
中外在肿瘤用药上存在巨大的差异。
就存量来看,与国外以靶向小分子、单抗药物为主导不同,国内抗肿瘤治疗手段以传统药物为主,抗代谢类、铂类、抗生素、植物药和烷化剂等传统非靶向药物在样本医院仍然占据可观的市场规模,至2016年占比仍然达 65%。随着肿瘤治疗方式的变化,靶向药物市场规模不断增长,在样本医院 2012 年治疗肿瘤的靶向小分子和单抗合计市场规模不到 30 亿元,2017 年已经超过 50 亿元。随着国家鼓励抗肿瘤药物进口的政策推进(进口抗肿瘤药物免关税等),以及本土药企新药的上市,靶向药物的市场规模将越来越大。靶向药物不仅是当前抗肿瘤药物极其重要的一部分,在未来也将成为整个医药行业中最具潜力,增长最强劲的领域。
表1:2012-2016年各类别抗肿瘤药物中国医院市场份额变化(样本医院)
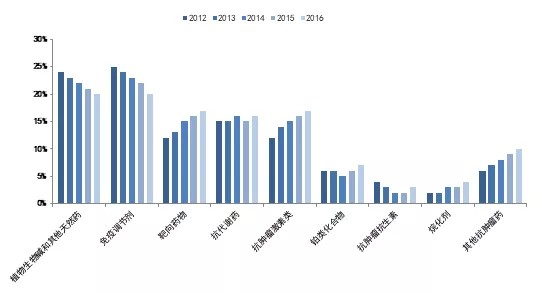
资料来源:PDB、华医资本
另外值得注意的一点是,近年来靶向药获批占比越来越高。
1997 至 2017 年,FDA 共批准 141 个抗肿瘤药物上市(不含辅助药物),其中化学药物 106 个,其中有 50 个常规化疗药物和 56 个分子靶向药物,生物制品 35 个(包括 2 个 ADC)。
1997 年 FDA 批准了第一个靶向肿瘤药物——利妥昔单抗,开启了肿瘤治疗的新时代;1997 年至 2005 年间有少数靶向小分子和大分子单抗上市,靶向药物正在快速发展中;2005 至 2017 年间 FDA 批准的抗肿瘤药物中,靶向药物所占比例越来越高。2015 年批准的 14 个抗肿瘤药物中,靶向药物达到 12 个,2016、2017 年批准的全部都是靶向药物。由此可见肿瘤治疗的是在向更加精准的靶向治疗发展的。
表2:1997年-2017年FDA批准的肿瘤药物及类型
资料来源:PDB、华医资本
更加精准的治疗
肿瘤传统分型加基因分型确定治疗手段
肿瘤传统分型中先以肿瘤发生部位分型例如肺癌、胰腺癌、肝癌;然后以每个部位肿瘤的发生特征进行分型,如肺癌可以分为非小细胞肺癌和小细胞肺癌等。随着靶向治疗的崛起,肿瘤用药指南中也更加注重某些突变基因的检测,在不同的基因突变中,推荐的治疗方案也不同。以非小细胞肺癌为例,美国NCCN推荐指南中,对于ALK+非小细胞肺癌优先推荐艾乐替尼作为治疗方案,而在EGFR+的非小细胞肺癌中则是以第三代EGFR靶向药奥希替尼作为优先推荐。而其他NSCLC则是以紫杉醇+卡铂+贝伐珠单抗作为优先推荐治疗方案。
图1:肺癌分类
资料来源:华医资本
图2:FDA一线疗法推荐
资料来源:华医资本
这意味着我们在做投资研究中更应该关注靶点研究,而不是笼统看药物的疗效和适应症。
从靶点的作用机制,我们可以清晰的了解其适应症的广泛程度、可能的副作用及预期疗效。例如PD-1之所以成为一个非常有潜力的靶点,不光是其疗效突出(但疗效依然是先决条件),还因为PD-1是一个癌症治疗的广谱靶点,以默克的Keytruda(以下称为K药)为例,其上市批准适应症为恶性黑色素瘤,但是其适应症拓展潜力无限。PD-1策略治疗在近几年连续突破非小细胞肺癌,肝癌等大适应症也为其几十亿美元的销售额做出巨大贡献。
全球靶点研究
靶点数量繁多,分类研究事半功倍
纽约癌症研究所(CRI,Cancer Research Institute)于2018年10月19日再次公布《全球肿瘤免疫治疗发展趋势》调查报告,根据调查显示全球有417个处于临床阶段的靶点。相比2017年,2018年肿瘤免疫治疗全球项目数增加67%,靶点数增加50%,有临床开发项目的企业与机构数增加42%,肿瘤免疫治疗蓬勃发展。另外,全球50%的研究项目集中在最热门的48个靶点上。如此数量繁多的靶点使得,如何系统地去研究每个靶点的潜力、市场、竞争等投资要素成为难题。通过靶点作用机制进行专业分类,机制类似的靶点相互比较研究。由于同一类靶点(如受体类酪氨酸激酶、血管形成靶点)会有一定的共性,所以对同一类靶点相互比较能更清晰地了解其优势。然后将其中的新药再与临床1线药物数据相比较,这才是我们的研究思路。
靶点的分类体系
根据靶点作用机制的区别,肿瘤作用的靶点可以分为靶向肿瘤形成调控机制、靶向肿瘤微环境、肿瘤免疫治疗、肿瘤标志物及靶向肿瘤干细胞 (完整分类见文章最后)。
靶向肿瘤调控/形成机制
肿瘤形成调控机制靶点的异常通常是一些肿瘤形成的原因,这类靶点的异常(通常为突变)会激发下游一系列信号通路,从而导致肿瘤细胞相比起正常细胞的分裂、生长、代谢、细胞环境、血管等众多异常。比如酪氨酸激酶是人体中的一大类激酶。
酪氨酸激酶是在细胞中催化磷酸基团从ATP中转移到蛋白质的酪氨酸残基上的酶,起到调控细胞中信号通路的“开”与“关”,像最常见的酪氨酸激酶类靶点EGFR,ALK靶点就属于该类靶点,类似泛素调控,丝氨酸苏氨酸激酶通路均属于该类靶点。需要提的一点是分类中肿瘤代谢和分裂周期调控蛋白中一些靶点也属于酪氨酸激酶和丝氨酸苏氨酸激酶(如CDK家族),但是没有归于酪氨酸激酶或丝氨酸苏氨酸激酶原因是CDK家族功能更加单一只调控细胞的分裂周期,并且位置更加偏向下游。
靶向肿瘤微环境
靶向肿瘤微环境主要分为两块,肿瘤血管形成和肿瘤基质细胞。血管形成是恶性肿瘤形成的必要条件。血管形成为肿瘤的生长提供能源,为肿瘤的转移提供路径。也因此抑制肿瘤血管形成变成了治疗肿瘤的重要手段。肿瘤血管抑制剂也是如今抗肿瘤药物研发的热门,如热门靶点VEGF/VEGFR家族,Ang1/2等,并且也有多款成功药物已经上市。
一个肿瘤中不光有肿瘤细胞,还有其环境的基质细胞。成纤维细胞是最主要的基质细胞,癌相关成纤维细胞(CAFs)也被称为活化的成纤维细胞或肌性成纤维细胞,这些细胞为肿瘤形成一个物理屏障,这个屏障保护肿瘤免受CAR-T等多种抗肿瘤药物的攻击。现在有许多研究为了攻克CAR-T实体瘤浸润性的难关。CAR-T疗法与纤维溶解药物联用也是探索方向之一。
免疫检查位点及免疫调控靶点
靶向免疫调节的靶点中包含了最近大放异彩的免疫检查位点,目前国际上在研究的T细胞相关免疫检查点有(括号中为管线数)PD-1(108例),CLTA-4(44例),IDO(36例),4-1BB(27例),OX40(24例),LAG-3(22例),TIM-3(18例),TIGIT(18例),VISTA(7例),ICOS(4例)。组织表面或抗原呈递细胞相关免疫检查点,PD-L1(88例),B7-H3(5例),B7-H4(2例),B7-H6(1例),PD-L2(1例),GRAF(1例)。
虽然PD-1和PD-L1效果喜人,但免疫检查位点依然存在种众多不确定性。就在今年被誉为下一个“PD-1”靶点的IDO意外的在临床三期失败,三期临床试验中IDO抑制剂联合K药一线治疗晚期黑色素瘤结果显示,IDO抑制剂的加入无法改善治疗效果。从复旦大学的天价专利到压力下前进,也给免疫检查位点药物投资一个警醒。另外一种免疫环境调控的靶点,研究已经较长时间,免疫调控因子药物就属于这一类,辅助用药较多。
肿瘤特异性标志物
肿瘤特异性抗原(tumor specific antigen)指仅表达于某种肿瘤细胞表面而不存在于正常细胞上的新抗原,故又称独特肿瘤抗原(unique tumor antigen)。这一类靶向药物可以通过抗体依赖细胞毒性(ADCC)或补体依赖细胞毒性(CDC)杀伤肿瘤细胞。该类靶向药物通常有细胞疗法,单抗,抗体偶联类药物(ADC)这些药物。此类抗原可存在于不同个体同一组织类型的肿瘤中,如人恶性黑色素瘤基因编码的黑色素瘤特异性抗原可存在于不同个体的黑色素瘤细胞,但正常黑色素细胞不表达。通常CAR-T疗法靶点选择需要去选择一个高效的,特异性极强的肿瘤标志物,在实体瘤中难以发现一个理想的靶点,这也是目前CAR-T实体瘤难以突破的原因之一。
靶向肿瘤干细胞
传统观念认为,肿瘤是由体细胞突变而成,每个肿瘤细胞都可以无限制地生长。但这无法解释肿瘤细胞似乎具有无限的生命力以及并非所有肿瘤细胞都能无限制生长的现象。肿瘤细胞生长、转移和复发的特点与干细胞的基本特性十分相似。因此肿瘤干细胞是肿瘤细胞中一群拥有自我更新能力的细胞,并且被认为是导致癌变,促进癌症进程,肿瘤转移,癌症复发的原因。
并且肿瘤干细胞的表面抗原与肿瘤细胞有很大区别,例如肿瘤干细胞表面抗原少,相比起肿瘤细胞更难消灭。肿瘤干细胞也被认为是治愈后肿瘤复发的原因之一。
结论
热门靶点竞争白热化,不应该忽视相对“冷门”的靶点
当肿瘤精准治疗变成未来的主流方向,抗肿瘤药物投资研究也要更加“精准化”而不是仅仅以传统的肿瘤适应症分类方式研究。并且417个已有临床试验的靶点中,各个靶点的研发热度也大不一样。热门靶点如PD-1全球有上百个项目在同时进行,虽然PD-1研究相对于一些“较冷门的靶点”风险较低,但是其市场已有多款药物上市,市场较为拥挤。如PD-1国内市场已经有进口K药、O药,国产的君实生物的特瑞普利单抗注射液和信达生物的信迪利单抗,同时恒瑞生物和百济神州的PD-1单抗也已经递交新药上市申请。像一些热门靶点EGFR,VEGF等都有多款药物专利即将过期,仿制药将会大量进入。因此,我们不能忽略一些研究相对较少的靶点的潜力。
现阶段我们已经发现了一些具有成药性,极具潜力的靶点,有适应症人群广泛、特异性强等特点。
欲知详情,欢迎来华医资本提出建议和共同探讨。
注:本文参考Medsci,Nature review,Cell等众多文献,参考文献不一一列出